产品中心Cell Resources
联系我们CONTACT US
 18225607483
18225607483
24小时服务热线 355185756@qq.com销售邮箱
355185756@qq.com销售邮箱
产品详情
双萤(荧)光素酶检测服务
产品简介
萤(荧)光素(Luciferase)是自然界中能够产生生物发光的酶的统称,其中最有代表性的是来自萤火虫体内(Firefly)和海肾(Renilla)体内的两类萤光素酶,分别命名为F-Luciferase和R-Luciferase。在荧光素酶的催化下,荧光素底物可以高效的转变成氧萤光素,同时发出强烈的光。
鉴于此,研究者利用荧光素酶开发出一套极其灵敏且使用方便的基因报告系统。目前这一系统被广泛用于转录因子结合位点与启动子活性分析、RNA降解、信号转导、药物筛选、动物活体成像等领域。
服务推荐
● 转录因子结合位点与启动子活性分析
● miRNA靶基因验证
● lncRNA吸附miRNA验证
● circRNA吸附miRNA验证
● 专业的实验方案设计
技术特点
● 强大的学术支持团队协助设计科学合理的实验方案
● 极简的HB-infusion无缝克隆策略极大缩减载体构建周期
● 高效的LipoFiter转染试剂和病毒转导系统,确保结果稳定和可重复性
● 详细的原始数据和实验结果分析,确保结论清晰可靠
两种常用载体类型极其应用场景
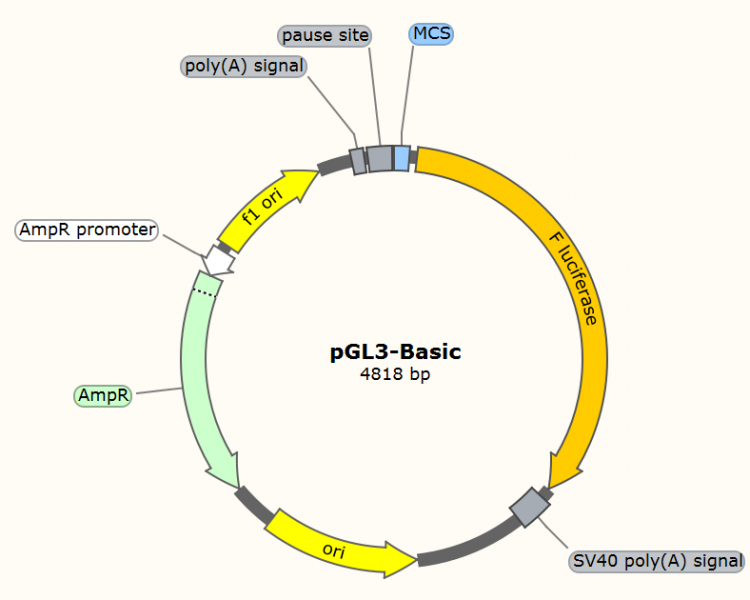
● pGL3-Basic---用于转录因子结合位点与启动子活性分析。把待分析启动子区段构建到F-Luciferase上游,和转录因子共转染分析F-Luciferase活性即可反应启动子的活性高低。该质粒通常需要结合持续性表达R-Luciferase的载体作为内参以校正不同样品之间转染的转染效率(参考案例一)。
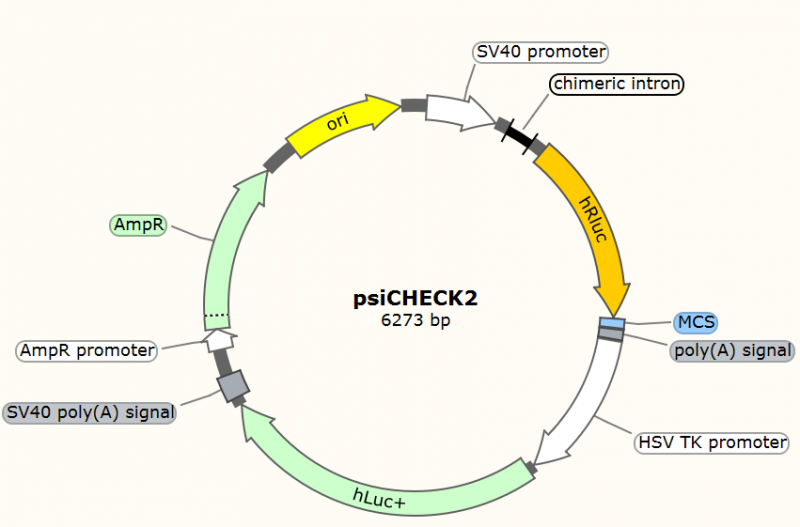
● psiCHECK2---miRNA与其靶点相关分析,包括miRNA靶基因验证(参考案例二A和B)、lncRNA (参考案例三)与circRNA (参考案例四)吸附miRNA验证等。需要把miRNA潜在结合靶点克隆到R-Luciferase (hRLuc) 3’UTR区域,然后与待测miRNA共同转染细胞内测定R-Luciferase活性高低,F-Luciferase (hLuc+)作为校正内参校正不同样品之间转染的转染效率。
技术路线
经典应用案例1
● LncRNA转录因子结合位点与启动子活性分析
论文来源: Wang, P., et al. (2014). "The STAT3-binding long noncoding RNA lnc-DC controls human dendritic cell differentiation." Science 344(6181): 310-313.
本文是曹雪涛实验室在2014年发表在Science上一篇研究性论文。作者通过芯片鉴定出DC (树突状细胞)发育相关的一个lncRNA,命名为lnc-DC。同时高通量测序也发现了这条差异lncRNA的存在。进而作者通过Northern Blot验证了这条lnc-DC。由于lnc-DC极其特异和稳定地高表达在DC发育过程的某一时期,所以作者假设lnc-DC可能是和表观遗传学调控事件相关的。为了验证这一假设,作者通过染色体免疫沉淀结合测序的技术-CHIP-seq和qPCR发现lnc-DC的转录起始位点(TSS)附近富集了Pol II、H3K4me3和H3K27ac等蛋白,提示DC发育过程中表观遗传学变化与lnc-DC的转录增强事件相对应。进而作者通过序列分析发现在lnc-DC的转录起始位点附近(+44-+50)存在一个经典的PU.1结合位点。作者假设PU.1参与了lnc-DC的特异性表达。于是作者设计了如下实验进行了进一步的验证。
作者把lnc-DC的启动子区段(-1447-+223)及其不同的突变体版本分别克隆到F-Luciferase表达框上游,然后和转录因子PU.1表达质粒或者空载体(Vector)共同转染到模式细胞系HEK-293T,通过测量荧光强度的变化间接反应转录活性的高低。最终证明转录因子PU.1通过经典结合位点(+44-+50)介导了lnc-DC在DC发育过程中的特异表达。
经典应用案例2
● LncRNA通过吸附miRNA调控靶基因mRNA的表达 (ceRNA)
论文来源: Cesana, M., et al. (2011). "A long noncoding RNA controls muscle differentiation by functioning as a competing endogenous RNA." Cell 147(2): 358-369.
作者通过表达分析发现了一条肌肉发育相关的lncRNA---lnc-MD1.前期功能研究发现lnc-MD1可以调控肌肉分化的时间。信息学分析发现这条肌肉特异的lncRNA上包含36个miRNA的结合位点。如果只考虑肌肉发育相关的miRNA和基因,36个候选miRNA里面只剩下miR-133和miR-135。作者通过荧光素酶实验进行了验证。首先作者把野生型及其缺失miR-133和miR-135结合位点的Lnc-DC1克隆到进R-Luc的3’UTR,然后分别与表达miR-133和miR-135前体的质粒共同转染到细胞进行荧光素酶活性检测。证明lnc-MD1缺失存在miR-133和miR-135的结合位点。
进一步的信息学预测,miR-133和miR-135分别靶向两个基因- MAML1 和 MEF2C。同样,作者还是通过荧光素酶实验进行验证。研究者把MAML1 和 MEF2C的3’UTR (WT)和miRNA结合位点缺失突变体(-mut)分别克隆在RLuc表达框的下游,然后和miRNA过表达载体共转染细胞进行酶活测定。结果显示miR-133和miR-135确实分别靶向了MAML1 和 MEF2C两个基因。最后的模型是lnc-MD1通过ceRNA机制吸附miR-133和135,正向调控了MAML1 和 MEF2C的表达,参与调控肌肉发育。














